苦难与荣耀
(一)
是我在撒谎,还是他们在撒谎?
最危险的,不是自然界中的动物,而是那些在实验室里编辑病毒,对病原体的致病能力、传播能力进行功能增益改造的人。这本应是一个公民常识。能否建立这一常识,重视、警惕这一常识,关系到你、我、他,关系到我们的家人,我们所有亲人的安全,关系到灾难会否一次次重演,关系到我们的子孙后代和人类未来的命运。
功能增益研究,奥巴马禁令,禁令撤销,疫情出现
功能增益研究,也称为功能获得性研究(Gain-of-Function,缩写为G-o-F),是指通过基因编辑、基因改造手段,人为增强病毒(及其它病原体)的致病能力或传播能力。
鉴于“功能增益研究”存在巨大的潜在危险,鉴于美国及世界各国多次发生实验室泄漏事故的一再警示,2014年10月22日,奥巴马总统颁布了一项针对“功能增益研究”的禁令,禁止科学家进行危险病原体的功能增益研究,即禁止在实验室改造病毒或其它病原体,人为增强它们的致病能力或传播能力。
然而,3年后,2017年12月19日,Trump政府撤销了奥巴马政府颁布的“功能增益研究”禁令,允许美国科学家重新申请联邦经费,开展人为增强病毒或病原体致病能力、传播能力的功能增益研究。
支持功能增益研究者声称,该类研究模拟了自然界未来可能发生的危险病毒突变,有预测、预防大流行病的作用。功能增益研究的重要支持者,Trump政府撤销奥巴马禁令的主力推手之一,美国国家卫生研究院(National Institutes of Health,NIH)院长弗朗西斯·柯林斯(Francis S. Collins)在禁令解除时说:“功能获得性研究非常重要,能够帮助我们识别快速演化的、对公众健康构成威胁的病原体,并制定有效对策。”
2017年12月撤销功能增益研究禁令,2019年底新冠疫情发生,这只是个巧合吗?
自2017年12月到2019年,美国病毒学家们在功能增益研究领域难道一事无成,没有制造出任何一种危险病毒吗?美国病毒学家制造出的危险病毒中,肯定没有新冠病毒吗?
新冠大疫情发生后,对2017年12月Trump政府重启“功能增益研究”,对大疫情恰好发生于奥巴马禁令撤销、“功能增益研究”重启两年后,美国政界、科学界、媒体界上上下下一个个讳莫如深、百般回避,装聋作哑、不置一词,仿佛撤销禁令,重启“功能增益研究”这一事实没有发生过,仿佛这一重大政策改变与新冠大疫情的发生毫无关系,无须进行任何调查、研究、反思、反省。
唯一的例外是前副国家安全顾问博明。 2021年6月8日,在美国国会参议院军事委员会举办的“美国与中国的战略竞争”听证会上,博明提出,美国应以身作则,停止功能增益研究,并恢复奥巴马政府的功能增益研究禁令。博明说:“功能增益研究旨在帮助预测当前的大流行病,但实际上可能反而为这次大流行埋下了种子”。
内容摘要 新冠是怎样被设计成病毒集大成者的
1、参照跨物种传播能力最强的病毒rs3367,设计、确定新冠刺突蛋白受体结合域的5个关键氨基酸,这5个关键氨基酸决定冠状病毒的人体细胞感染能力和跨物种传播能力。这一组设计取得了如下效果:
a) 新冠刺突蛋白与hACE2(人类细胞ACE2受体)的结合能力极强,这使得新冠病毒能够非常容易地进入、感染人体细胞;
b) 相比SARS刺突蛋白与hACE2的结合亲和力,新冠刺突蛋白与hACE2的结合亲和力提高了10-20倍;
c) 人类ACE2与新冠刺突蛋白的结合亲和力,在脊椎动物之中最强(相关对比实验中,人类ACE2与新冠刺突蛋白的结合亲和力,大于其它13种脊椎动物ACE2与新冠刺突蛋白的结合亲和力,见稍后将介绍的澳大利亚弗林德斯大学论文)。这说明,人类ACE2最适合与新冠刺突蛋白结合,人体细胞是新冠的最佳感染对象,新冠刺突蛋白受体结合域的5个关键氨基酸是专门为感染人类设计的。
2、借鉴艾滋病、埃博拉、鼠肝炎等病毒,为新冠也提供了furin酶切位点,并且将furin酶切位点恰好设置在刺突蛋白两个亚基S1蛋白、S2蛋白的连接交界处。这一设计取得了如下效果:
a) 新冠刺突蛋白与hACE2结合后,它的两个亚基S1、S2蛋白将被furin蛋白酶切割,S1蛋白之下的S2蛋白及病毒包膜将与人体细胞膜直接接触并发生膜融合,膜融合后,病毒包膜内的病毒RNA将直接释放到人体细胞中,第一时间在细胞内复制、组装新的新冠病毒。
b) SARS病毒没有furin酶切位点,不能发生膜融合,不能通过膜融合直接释放病毒RNA迅速展开病毒复制。相比以胞吞方式进入人体细胞的SARS病毒,新冠病毒感染人体细胞、在人体细胞内复制的效率提高了100-1000倍。
3、在S1、S2蛋白结合处设置furin酶切位点,还赋予了新冠病毒以膜融合的方式感染并杀死T淋巴细胞,破坏人体免疫系统的能力。这项能力SARS病毒同样也不具备。
4、借鉴艾滋病病毒HIV-1,在S1蛋白基因组中插入了表面糖蛋白gp120和Gag蛋白的基因,使新冠病毒可以象HIV-1那样结合另一种人类细胞受体CD4,进而感染、杀死CD4+T淋巴细胞(表面附着CD4受体的T淋巴细胞)。这一设计赋予了新冠第二种破坏人体免疫系统的能力;
5、借鉴埃博拉病毒的相应结构,在furin酶切位点附近(即S1、S2亚基结合处附近)为新冠设计了一个O-Linked聚糖结构,这一结构能与人体细胞表面的某些蛋白质相互作用,形成一个可逃避免疫打击的糖链屏障,从而使新冠病毒获得了逃避人体免疫系统打击的能力。这一设计有如下具体效用:
a) 大大延缓了人体的免疫反应,使新冠病毒获得了较长的潜伏期,它得以隐蔽地在人体内巨量复制,并几乎无所不至地向各个器官、组织扩散;
b) 使新冠病毒具备强悍的人体适应生存能力,难以被彻底清除或根除。
6、借鉴71型人肠道病毒HEV71,在新冠核衣壳蛋白(N蛋白)基因组中加入了nsp3A编码,赋予了新冠干扰、抑制人体免疫系统的能力,进一步完善、加强了新冠病毒的抗免疫能力。这一设计的具体作用包括:
a) 干扰免疫信号传递,抑制免疫应答,使人体免疫反应延迟或减弱;
b) 使人体在免疫反应延迟后过度反应,引发“细胞因子风暴”,重创人体。这可能是新冠病人病情常常突然加重、恶化,以及轻症、普通病人会突然转为重症,甚至不治的一个重要原因。
c) 使新冠病毒能够对抗、反制RNA干扰药物,使RNAi免疫疗法无效或低效。
7、借鉴艾滋病病毒(HIV-1)、人类嗜T淋巴球病毒一型(HTLV-1)等逆转录病毒,为新冠设计了逆转录(以RNA为模板合成DNA)功能。这一设计的效果包括:
a) 新冠的RNA可逆转录并整合到人体被感染细胞的DNA中;
b) 康复患者体内仍存在新冠病毒RNA;
c) 许多康复患者的PCR检测结果仍为阳性。实际上这些康复患者体内应该并没有完整成形的新冠病毒,检测到的RNA是被逆转录到人体细胞中的新冠RNA。新冠设计者实现了将新冠RNA整合到人体细胞DNA的逆转录功能,但应该没有实现由这些RNA组装出各种蛋白及完整新冠病毒的功能。
以上内容摘要总结了新冠的部分设计要点而非全部。对新冠的其它人为设计特征或者说实验室指纹,本文后续可能会适当补充,或在其它文章中再行总结。
本系列文章将依次展开上述7个新冠设计要点,并提供每一要点的证据。首先聚焦第一个要点。
I、参照跨物种传播能力最强的病毒rs3367,设计了新冠RBD的5个关键氨基酸,赋予了新冠感染人类的能力及跨物种传播能力。这一设计使新冠刺突蛋白与hACE2的结合亲和力,相比SARS提高了10-20倍;而且,新冠刺突蛋白与hACE2的结合亲和力,比它与任何其它脊椎动物ACE2的结合亲和力都要强。新冠刺突蛋白RBD的5个关键氨基酸是专门为感染人类而设计的。
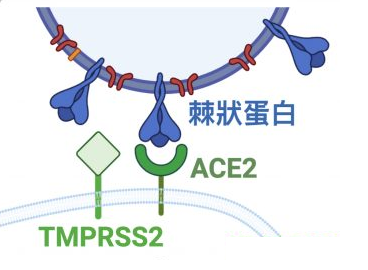
病毒能否进入宿主细胞,感染宿主,取决于它有没有打开宿主细胞(锁)的“钥匙”。附着在宿主细胞表面的相关受体,如ACE2,TMPRSS2,CD4等,相当于细胞的“锁”,如果病毒有匹配某个细胞“锁”(细胞受体)的“钥匙”,它就能与该受体结合,并在受体的介导下进入(感染)宿主细胞。

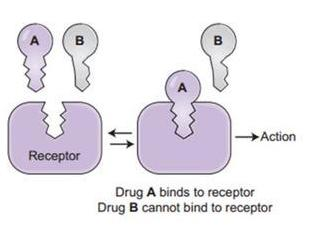
冠状病毒用来打开细胞锁的“钥匙”,就是它的S蛋白,即Spike蛋白,也叫刺突蛋白或棘状蛋白。

刺突蛋白由相连的两个部分(也叫两个亚基)组成,向外突出的部分是S1蛋白,连接S1蛋白与病毒包膜的是S2蛋白。S2蛋白也叫膜融合亚基(新冠病毒的S2蛋白参与病毒包膜与宿主细胞膜的膜融合过程),它相当于病毒钥匙的手柄部分;S1蛋白也叫受体结合亚基,它负责与宿主细胞表面的受体(“锁”)结合,相当于病毒钥匙的齿面部分。
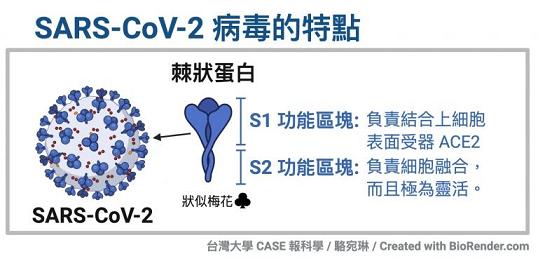

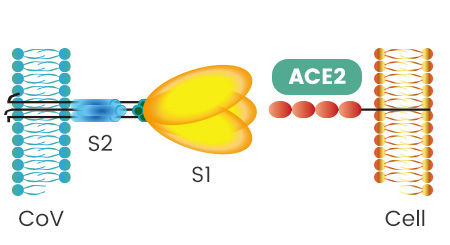

S1蛋白中有一个区域叫做受体结合域(Receptor Binding Domain),简称RBD,RBD是S1蛋白与细胞受体发生接触的部分,它相当于病毒钥匙齿面的钥齿部位。

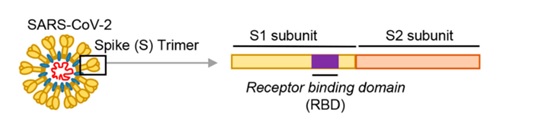
RBD中有14个氨基酸与宿主细胞受体ACE2直接发生接触,这14个氨基酸中的5个对刺突蛋白能否与ACE2结合起决定作用,这5个氨基酸是冠状病毒打开宿主细胞锁的5个关键钥齿。

如果这5个氨基酸与ACE2适配,刺突蛋白就能与ACE2成功结合,宿主的细胞锁就成功打开了,冠状病毒将得以进入、感染ACE2所附着的细胞。
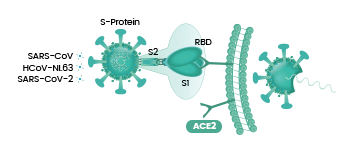

注:ACE2,即Angiotensin Converting Enzyme2,血管紧张素转换酶2,是细胞表面的一个膜蛋白,广泛存在于脊椎动物的呼吸、消化、血液、泌尿、生殖、神经(如眼组织相关细胞,嗅觉相关细胞等等)等系统的器官、组织内。ACE2可介导与之发生结合的病毒进入它所附着的细胞内部。ACE2也是肾素-血管紧张素系统(RAS)中的一个关键酶。
因此,要人为赋予病毒感染某种宿主(如人类)的能力,只要为它提供或设计出适配的RBD5个关键氨基酸就足够了。这至少可以通过以下三种方式来实现:
a) 病毒嵌合。将病毒A刺突蛋白(或S1蛋白或RBD)的基因序列嵌合到病毒B的基因序列之中,病毒B就将获得病毒A的5个关键氨基酸,同时继承A的宿主感染能力;
b) 完全抄袭、复用。让病毒B直接抄袭、复用病毒的5个关键氨基酸,病毒B也将获得病毒A的5个关键氨基酸,同时继承A的宿主感染能力;
c) 复用+替代。参照病毒A的5个关键氨基酸,让病毒B只复用A的部分关键氨基酸,尽可能用性质相近的氨基酸替代其它关键氨基酸,以使病毒B具备与病毒A相近的宿主感染能力。
单纯使用前二个方式非常简单、方便,但人为痕迹也极为赤裸;第三个方式既有一定的人为痕迹隐蔽性,也有一定的技术挑战性。复用得越少,替代得越多,隐蔽性就越强,但技术难度也越大。
经过上述准备之后,可以提出如下问题了:新冠病毒刺突蛋白RBD决定人类感染能力的5个关键氨基酸,是怎么来的呢?答案是:这5个关键氨基酸,是参照、基于特殊病毒rs3367的5个关键氨基酸,复用+替代得到的。
下表显示了新冠病毒、rs3367病毒,二者5个关键氨基酸的对应关系。括号内的数字代表氨基酸在刺突蛋白氨基酸序列中的编号。
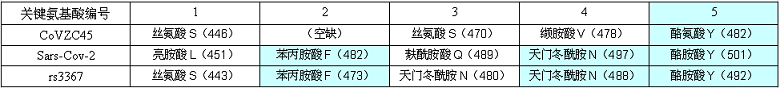

由表可见,新冠、rs3367的五个关键氨基酸中有三个是相同的:
它们的第五关键氨基酸同为酪氨酸Y;
第四关键氨基酸同为天门冬酰胺N;
第二关键氨基酸同为苯丙胺酸F;
也就是说,新冠复用了rs3367五个关键氨基酸中的三个:第五、第四、第二关键氨基酸。
新冠设计者没有继续复用rs3367的第三关键氨基酸-天门冬酰胺N,而是为新冠精心挑选了一个替代者,与天门冬酰胺N理化属性非常相似或接近的麸酰胺酸Q,以之作为新冠的第三关键氨基酸。
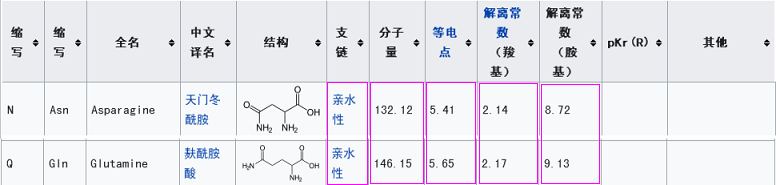

新冠设计者最后选定了亮氨酸L(白氨酸),以之作为新冠病毒的第一关键氨基酸。选择亮氨酸L的第一考量,不是它是否与rs3367的第一关键氨基酸-丝氨基酸S理化性质最接近,而是它应与已选定的前四个关键氨基酸整体上最配套:新冠五个关键氨基酸的结构体、RBD的结构体,在与hACE2相互作用时,它们与rs3367对应的结构体,应大致同构或大致等效。
关于新冠5个关键氨基酸与rs33675个关键氨基酸之间复用、替代关系的更详细分析、解读,可参见我之前的一篇文章:新冠RBD5个关键氨基酸抄袭、替换自rs3367。
为什么设计新冠关键氨基酸时要参照、复用rs3367的关键氨基酸呢?因为rs3367是已知的自然界中跨物种传播能力最强的病毒。绝大多数蝙蝠或动物来源的冠状病毒都不能跨越自然界设置的物种传播屏障,它们只能感染特定的动物,但不能进入人体细胞,不能感染人类。但事有例外,rs3367及另一个相似病毒rsSHC014就是罕见例外中的两个。这两个蝙蝠冠状病毒都具备跨物种传播能力,它们的刺突蛋白都能与hACE2(human ACE2,人体细胞ACE2受体 )良好结合。另一个奇特之处是,它们虽然可以进入人体细胞,但却不会使人发病。同时,这两个病毒虽然本身对人体无害,但功能增益研究可以利用它们的人类细胞感染能力来制造人类致病性病毒。两者之中,rs3367更非同寻常,它是已知的自然界中跨物种传播能力最强的病毒,它能感染的动物包括但不限于:人类、果子狸、貉、恒河猴、雪貂、水鼬、猫、猫、蝙蝠、老鼠等等。新冠设计者借鉴、复用、替代rs3367 RBD的5个关键氨基酸,就是要使新冠病毒继承、模仿它的非凡跨物种传播能力,特别是感染人体细胞的能力。
rs3367病毒(GenBank ACCESSION ID: KC881006),又称WIV1病毒,它的病毒毒株是2012年3月从云南昆明中华菊头蝠(又称中华马蹄蝠)的肠道与粪便样本中分离获得的;rsSHC014(GenBank ID: KC881005),亦称SHC014病毒或SHC014-CoV,它的病毒毒株是2011年4月获得的,也分离自云南昆明中华菊头蝠(亦称中华马蹄蝠)的肠道与粪便样本。rs3367与rsSHC014这两个具备跨物种传播能力的罕见特殊类SARS冠状病毒彼此非常相似,它们全基因组序列的一致性或相似度为98.8%。rs3367,rsSHC014的全基因组序列(核苷酸序列),以及WIV1病毒S蛋白(GenBank ID:KC881007,收集时间是2012年9月)的基因序列,都是2013年4月8日这一天上传到NCBI(National Center for Biotechnology Information,美国国家生物技术信息中心) GenBank生物数据库,实现国际共享的。
还需要说明rs3367与WIV1的关系。WIV1病毒(GenBank ID:KF367457,全基因组序列的上传时间为2013年7月),在某些论文中也称WIV-CoV或SL-CoV-WIV1,它与rs3367病毒全基因组序列的同一性或相似度为 99.92% ,在决定物种感染能力(宿主范围)的spike蛋白S1亚基部分,它们的氨基酸序列同一性为 100%。在不同论文中,有时使用rs3367,有时则使用WIV1,其实它们可以相互替代,不会对论文产生任何实质影响。为描述方便,本文将它们视为同一病毒。
参照rs3367的关键氨基酸设计新冠的关键氨基酸达到了什么效果呢?我们看两篇论文。
论文一。2020年3月13日,美国德克萨斯大学奥斯汀分校Jason S McLellan团队,及美国国家过敏和传染病研究所的研究人员在《Science》杂志上联合发表了一篇论文:Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation(膜融合前构象中2019-nCoV 刺突蛋白的冷冻电镜结构)
https://science.sciencemag.org/content/367/6483/1260
这篇论文发表于预印本平台biorxiv的时间是2020年2月15日。
https://www.biorxiv.org/content/10.1101/2020.02.11.944462v1
论文指出: 2019-nCoV(新冠,Sars-Cov-2的旧称)S1蛋白与hACE2的结合亲和力,是Sars-Cov S1蛋白与hACE2的结合亲和力的10-20倍。
论文二。2020年5月13日,澳大利亚弗林德斯大学的科学家团队在预印本平台arxiv发表了一篇论文:In silico comparison of SARS-CoV-2 spike protein-ACE2 binding affinities across species and implications for viral origin(新冠刺突蛋白与ACE2结合亲和力的跨物种模拟比较及其对病毒起源的指示)
https://arxiv.org/abs/2005.06199
https://arxiv.org/ftp/arxiv/papers/2005/2005.06199.pdf
由于论文强烈指示着新冠病毒可能来自实验室,是专门针对人类设计的,这一论文被压制了超过13个月,直到2021年6月24日,论文才得以发表于《Nature Science》(《自然医学》)杂志。 https://www.nature.com/articles/s41598-021-92388-5
相比之下,德克萨斯大学Jason S McLellan团队的论文从2020年2月15日发表于预印本平台biorxiv,到2020年3月13日发表于《Science》杂志,只用了不到一个月的时间。
弗林德斯大学科学家的论文说了些什么呢?我归纳了以下要点:
a. 新冠病毒具备跨物种传播能力,除了人类,它还能感染穿山甲、猴子、仓鼠、狗、雪貂、猫等动物。
b. 通过分子动力学定量模拟研究,计算出了新冠S蛋白(刺突蛋白)与各物种ACE2 相互作用的结合能(binding energies for the interactions),各物种ACE2与新冠S蛋白的结合能从高到低依次为:人类 > 穿山甲 > 狗 > 猴子 > 仓鼠> 雪貂 > 猫 > 老虎 > 蝙蝠 > 麝猫 > 马 > 牛 > 蛇 > 老鼠。
c. 蝙蝠 ACE2与新冠S蛋白的结合亲和力或结合能不仅远低于人类 ACE2,而且也低于众多其它物种ACE2,不认为蝙蝠是新冠病毒的原始宿主;
d. 不认为穿山甲是新冠的中间宿主或原始宿主。原因之一是,迄今为止发现的所有穿山甲冠状病毒都缺乏新冠病毒S蛋白S1/S2 亚基交界处的furin(弗林)蛋白酶切位点;
e. 人体ACE2与新冠刺突蛋白的结合亲和力最强,远高于假设的原始宿主蝙蝠,也强于假设的中间宿主穿山甲,也就是说,人类ACE2是新冠刺突蛋白的最佳结合对象,人体细胞是新冠病毒的最佳感染对象。
f. 新冠最早的分离株( 2019年12月在武汉分离得到的新冠病毒样本)已经具备了与hACE2(人类 ACE2)的极佳结合亲和力,这意味着,从刚被发现起,新冠就极为适合感染人体细胞,人体细胞就已经是新冠的最佳感染对象,它没有表现出任何适应人类的过程。如果新冠是动物来源的,那么,从动物宿主转移到人类宿主之初,它更适合感染的,不会是人类,而应是它的动物来源宿主。人畜共患病病毒在跨越物种传播之初,通常对原始宿主物种表现出最高的结合亲和力。如果新冠病毒是动物来源的,那么它将需要一个感染人类的适应过程,它需要针对人体细胞ACE2进行刺突蛋白的变异以达到最佳的人类感染效果。然而,事实上,新冠病毒没有经历任何适应、变异的过程,它刚一被发现就直接达到了最佳的人类感染状态。
由上述6点,特别是e和f,可以作出以下引申或推论:
A. 新冠病毒的原始宿主可能就是人类;
B. 新冠病毒可能原本就是为人类量身定制,为感染人类而专门设计、改造出来的;
C. 疫情发生前,新冠病毒可能在人体细胞样本中培养过,已经在实验室中完成了对人体细胞的适应过程。
通过对rs3367 RBD关键氨基酸的借鉴、复用、替代,某个科学疯子为新冠病毒设计了可跨物种传播且最适合感染人类的RBD关键氨基酸及刺突蛋白。
哪些科学家对rs3367认识、研究得足够深,足够透呢?也许有必要挖掘一下这个问题的答案。
首先应该关注的,是中国科学院武汉病毒研究所的石正丽团队。rs3367和rsSHC014都是石正丽团队搜集、分离的,他们肯定是最了解这两个特殊病毒的人之一。2013年10月30日,中国石正丽团队、美国Peter Daszak(彼得-达斯扎克,生态健康联盟主席)团队在《Nature Science》杂志联合发表了一篇以rs3367为主角(论文也提及了rsSHC014)的重要论文:Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor(使用ACE2受体的蝙蝠类SARS样冠状病毒的分离和特征)
https://www.nature.com/articles/nature12711
论文第一作者为石正丽团队的葛行义,通讯作者为石正丽、达斯扎克。论文要点包括:
a. 以实验证实了rs3367(WIV1)的跨物种传播能力:它的刺突蛋白可与人类、果子狸、中华马蹄蝠(以及猪肾)等物种的ACE2受体结合,使病毒得以进入(感染)这些物种的细胞,在细胞内有效复制;
b. 这说明,自然界中也存在象Sars-Cov那样,使用ACE2受体感染细胞,可跨物种传播的动物来源的类SARS冠状病毒;
c. 某些蝙蝠类SARS冠状病毒,如rs3367,不需要中间宿主就可以直接感染人类;
d. 论文认为,rs3367的宿主中华马蹄蝠也是 SARS-CoV 的天然宿主;
e. 论文认为,rs3367是Sars-Cov起源于自然界的一项最有力证据。 rs3367、rsSHC014与Sars-Cov全基因组(总体核苷酸序列)一致性都约为95%。
需要指的是,该论文是一篇病毒跨物种传播研究论文,但不是一篇病毒功能增益研究论文。前面提到过,rs3367、RsSHC014这两个病毒虽然能够进入人体细胞,但不会使人发病,它们本身是对人体无害的。该论文证实了rs3367可跨物种传播,但没有对它或其它论文中涉及的病毒进行增强致病力或传播能力的功能增益改造。
预先提个醒,这篇2013年论文及它的第一作者葛行义,在后续有关论文的讨论中,还要涉及和用到。
石正丽团队,或Peter Daszak团队是对rs3367研究最深的人吗?不见得。北卡罗来纳大学教堂山分校的国际病毒学顶级权威Ralph S. Baric(拉尔夫.巴里克)及其团队对rs3367、rsSHC014的研究比石正丽团队,Peter Daszak团队还要深入、还要全面。Ralph S. Baric团队不仅深悉这两个病毒的跨物种传播特性,还将它们的跨物种传播特征用于功能增益研究,用这两个可感染人类细胞但对人体无害的病毒的刺突蛋白来合成可使人致病甚至致死的的人造病毒。
2016年3月14日,Ralph S. Bari团队在美国国家科学院院刊(PNAS,Proceedings of the National Academy of Sciences of the United States of America)发表了一篇以rs3367(WIV1)为研究主角的论文:SARS-like WIV1-CoV poised for human emergence(类SARS冠状病毒WIV1-CoV有感染人类的潜在危险)
https://www.pnas.org/content/113/11/3048
论文的部分要点为:
a. 用WIV1-CoV(即rs3367)的刺突蛋白与Sars-Cov-MA15的骨干合成了嵌合病毒WIV1-MA15。Sars-CoV-MA15是用SARS-CoV在实验室中经过多次传代培育出的可感染小鼠并使其致病、致死的Sars-CoV病毒变异体。
b. 实验证明,嵌合病毒WIV1-MA15能感染人体细胞,能容易地在人类呼吸道细胞、体内细胞样本中大量复制。不过,WIV1-MA15的致病力不及SARS严重;
c. 论文还研究了对嵌合病毒WIV1-MA15应用单克隆抗体,及使用SARS疫苗进行治疗的效果。
实验中合成的嵌合病毒WIV1-MA15毒株是用反向遗传克隆平台组装出来的;用于合成WIV1-MA15 的WIV1(即rs3367)病毒毒株WIV1-CoV,不是从自然界收集、分离得到的,同样是使用反向遗传克隆平台,基于rs3367的基因序列人工组装出来的。
Ralph S. Baric团队早在2003年SARS疫情结束后,就与美国范德堡大学和美国陆军传染病医学研究院合作研发了一套用于合成病毒的反向遗传克隆平台。2013年MERS疫情爆发时,该团队使用这一反向遗传克隆平台,率先合成了MERS病毒的全长cDNA克隆。Ralph S. Baric团队研发的反向遗传克隆平台是病毒改造研究所依赖的核心平台,其最大的特点就是,可以基于病毒的基因序列人工构建出具有活性的病毒毒株或克隆。这意味着:进行功能增益研究,或病毒改造时,可以先设计病毒的基因组序列,只要病毒的基因组序列设计、确定了,就可以用反向遗传克隆平台组装、构建出具有活性的病毒毒株。该平台还使病毒的基因编辑变得极为方便,编辑病毒的基因序列时可以不必每每在高等级生物安全实验室操作病毒毒株,可以在普通环境下,在电脑上编辑、修改记录基因序列的文本文件,根据需要,随时都可以组装、构建出新基因序列对应的病毒毒株。
2016的论文不是Ralph S. Baric团队的第一篇功能增益研究论文。
2015年11月9日,Ralph S. Baric团队在《自然医学》(Nature Medicine)杂志发表了著名的嵌合病毒论文:A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(一个类似SARS的蝙蝠冠状病毒群显示了感染人类的潜在可能性)
https://www.nature.com/articles/nm.3985
2016年论文用rs3367(WIV1)来制作嵌合病毒,2015年论文制作嵌合病毒用到的则是rsSHC014(SHC014病毒,SHC014-CoV)。两篇论文都使用了可感染小鼠的Sars-Cov变异体Sars-Cov-MA15。
2015年论文的部分要点为:
a. 用rsSHC014,即SHC014-CoV的刺突蛋白和Sars-Cov-MA15的骨干合成嵌合病毒SHC014-MA15;
b. 实验证明,SHC014-MA15能够有效利用hACE2感染人类呼吸道细胞,在细胞内大量复制,并产生相当于SARS的体外滴度(可理解为传染性相当于SARS);
c. SHC014-MA15可使实验小鼠致死;
d. 现有的针对SARS的免疫治疗和预防方法对SHC014-MA15治疗效果不佳,单克隆抗体和疫苗方法均未能中和并防止SHC014-MA15造成的感染。
Ralph S. Baric团队2015年论文为实验室改造致病性冠状病毒开创了一条重要道路,这是科学家第一次以嵌合方式改造出人类致病性危险病毒(但它不是基因编辑、改造致病性危险病毒的首例,功能增益研究的历史要早得多)。SHC014-MA15相当于新冠的一个早期原型,新冠也很可能使用了病毒嵌合的方式。当然,相比SHC014-MA15,新冠技术上更复杂,功能上更丰富、强大、完善;SHC014-MA15的实验室痕迹过于赤裸,新冠则有一定的“自然进化”伪装性。
2015年、2016年两篇功能增益论文的通讯作者都是Ralph S. Baric,第一作者都是Vineet D. Menachery(维内特·德梅纳赫里)。论文的参与者还包括其它美国、中国、瑞士三国的科学家。有二位中国科学家也在2015年论文中列名:石正丽、葛行义。
有一些文章不知是无意张冠李戴还是有意移花接木,它们将Ralph S. Baric(拉尔夫.巴里克)团队2015年11月在《自然医学》(Nature Medicine)发表的嵌合病毒论文归到了石正丽及其团队名下,称该论文是石正丽团队发表的。 列名第14作者的石正丽及列名第9作者的葛行义两人充其量只是参与了该论文的辅助性工作,根本算不上论文的主创人员。我们不妨看看石、葛二人在Ralph S. Baric 2015年论文中究竟做了些什么。
先看第9作者葛行义。2015年论文中说,“X.-Y.G. performed pseudotyping experiments”(葛行义完成了假分型实验)。根据论文相关内容可知,假分型试验是指:测量编码WIV1棘突蛋白的慢病毒进入表达hACE2的细胞的能力。
即,假分型实验的目的是确定WIV1病毒刺突蛋白结合hACE2,进入人体细胞的能力。注意,2015年嵌合病毒论文的病毒主角不是WIV1即rs3367,而是rsSHC014,也就是说,这一假分型实验并非论文中的重要实验;而且,2013年10月30日的《Nature Science》论文(石正丽团队、彼得-达斯扎克团队联合发表,葛行义为第一作者)早已实验证实了WIV1(rs3367)病毒刺突蛋白结合hACE2,进入人体细胞的能力(见前文所列2013年论文要点a),相关实验是2013年论文的核心实验。
https://www.nature.com/articles/nature12711
葛行义是否为Ralph S. Baric2015年论文重做了2013年的实验?或者做了一个结论相同的类似实验?我认为可能性很小,完全没有必要。因此,很可能,葛行义并没有为Baric2015年论文重做实验,他只是向Baric团队提供了自己2年前实验的相关情况、细节。
注1:假分型,pseudotyping,即假性病毒或假病毒,是人工改造或人工合成的,去除了毒性的缺损型病毒。制作假病毒与功能增益研究的相同之处是,都要对病毒进行实验室改造;不同之处是,功能增益研究人为增强病毒的致病能力(毒性)或传播能力,而制作假病毒不会增强病毒的致病能力或传播能力;
注2:慢病毒指潜伏期较长,缓慢发病的一类逆转录科病毒。
再来看第14作者石正丽。论文中说,石正丽的贡献是提供了SHC014刺突蛋白的基因序列和质粒。石正丽团队早在2013年4月8日就已将SHC014的全基因组序列上传到了NCBI GenBank数据库,Ralph S. Baric根本不需要石正丽专门向其提供GenBank上可开放查阅的SHC014的基因序列。而SHC014刺突蛋白的质粒(可理解为SHC014刺突蛋白的RNA片断及其载体),很可能早已通过中美合作的PREDICT项目进入了美国的病毒库(PREDICT项目稍后还将再述),Baric无须通过石正丽即可获得该质粒。而且,Ralph S. Baric可使用反向遗传克隆平台自行组装、构建出SHC014的刺突蛋白质粒。因此,石正丽对2015年论文的贡献“提供了SHC014刺突蛋白的基因序列和质粒”,也很可能不是专门为论文相关的研究提供的,而是在研究开始前就已经提供或共享过了。这也许就是石正丽列名第14作者(通讯作者Ralph S. Baric之前的最后一位作者),为该论文最次要作者的原因。
还有一个重要问题:石正丽团队进行过功能增益研究吗?
美国之音报导,2021年5月25日(星期二),来自肯塔基州的共和党籍联邦参议员兰德·保罗(Rand Paul)提出了一项修正案,禁止NIH(National Institutes of Health,美国国立卫生研究院)和其他联邦机构资助在中国进行的“增加功能”研究。这个修正案被加入到旨在与中国展开全面竞争的《美国创新与竞争法》。
引自VOA新闻:美参院通过修正案,禁止为武毒所及中国“增加功能”研究提供资助
https://www.voachinese.com/a/US-senate-amendment-gain-of-function-research-wiv-20210526/5905707.html
兰德·保罗称:纳税人的钱不应该被用来资助在武汉的增加功能研究,现在我们永久性地阻止了这个做法。
兰德·保罗的嘴脸太虚伪可笑了,他的言下之意莫非是:美国纳税人的钱只应该用作美国科学家功能增益研究的联邦经费么?
在5月举行的一场国会听证会上,兰德·保罗与美国国立过敏和传染病研究所(NIAID)所长、白宫首席医学顾问安东尼·弗契(Dr. Anthony Fauci)有过一段言辞交锋。
保罗批评NIH对中国的增加功能研究提供资助,弗契则说,这种说法是错误的。
弗契说:“保罗参议员,恕我直言,你是完全不正确的,NIH从来没有、现在也没有资助武汉病毒研究所的增加功能研究。”
兰德·保罗称NIH资助了武汉病毒研究所的功能增益研究;安东尼·福奇则称NIH从未资助武汉病毒研究所的功能增益研究。那么,武汉病毒研究所自身是否进行了功能增益研究?
“美国某些机构资助了武汉病毒研究所的功能增益研究”,这是一个移花接木捏造出来的谎言。
实际情况是怎样的呢?
其一,石正丽团队进行的“蝙蝠冠状病毒跨物种传播研究”与“病毒功能增益研究”不是一回事,至少从公开发表的论文看,石正丽团队从未人为增强过病毒的致病力或传播能力。
其二,美国某些机构确实资助过武汉病毒研究所,如美国国立卫生研究院 (NIH),美国国际开发署 (USAID) ,皮特·达萨克(Peter Daszak)为主席的生态健康联盟等,但他们所资助的,不是子虚乌有的“功能增益研究”项目,而是“预测:中国病原体探索”项目(PREDICT:China Pathogen Discovery)”。这一项目是“新发传染病PREDICT”项目的一个子项目,PREDICT项目是生态健康联盟等机构在美国国际开发署资助下于2009创办的一个全球性合作项目,这一项目与31~35个国家合作,在这些国家搜寻野生动物中的病毒样本,中国是其中之一。石正丽团队在中美合作中的分工是采集、分离蝙蝠病毒,并研究其跨物种传播能力。前面提到过的石正丽团队与皮特·达萨克(Peter Daszak)团队联合发表的2013年Nature Science论文就是这一合作的重要成果。武汉病毒研究所不是无偿接受资助,作为回报,石正丽团队要将自己在中国采集、分离得到的病毒样本提供给生态健康联盟。基于这种合作,大批来自中国的病毒样本被生态健康联盟运送至美国,充实美国的病毒库,同时用于美国科学家的病毒研究,包括功能增益研究。据统计,自2008年4月至2018年9月,通过PREDICT项目,美国从中国共获得了上万件动物及人体病毒。
迄今为止,我没有发现石正丽团队进行功能增益研究的任何记录,没有发现任何可靠可信的证据,有的只是捕风捉影的造谣。相反,确凿无疑的是,一再进行功能增益研究的,恰恰是美国病毒学家!Trump政府2017年12月19日撤销了奥巴马禁令(功能增益研究禁令),公开支持美国科学家开展功能增益研究,并为其提供联邦经费。奥巴马禁令撤销两年后,新冠大疫情就发生了,这只是一种巧合吗?
美国功能增益研究的代表人物之一是顶级冠状病毒、埃博拉病毒学术权威Ralph S. Baric及其领导的北卡团队。如前所述,该团队2015、2016年接连发表了两篇功能增益研究的重磅论文。这两篇论文都发表于2014年10月奥巴马功能增益禁令颁布之后,但论文相关的两项基于rsSHC014、rs3367的嵌合改造研究在禁令发布前就已申请立项,美国国立卫生研究院(NIH)对它们进行了审核,允许其继续进行。因此,Baric团队在奥巴马禁令发布后仍然完成了两项研究并发表了论文。
Ralph S. Baric及其团队成员还是吉利德公司特效药瑞德西韦(Remdesivir)的合作研发人员。2017年6月28日,Baric团队(北卡罗来纳大学教堂山分校流行病学系)、范德堡大学医学中心、波兰Jagiellonian University、吉利德科技等在《ScienceTranslational Medicine》杂志上联合发表了论文:Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses(广谱抗病毒药物 GS-5734可抑制流行性和人畜共患冠状病毒)
https://stm.sciencemag.org/content/9/396/eaal3653
论文中的GS-5734就是指瑞德西韦(Remdesivir)。论文指出:目前正在临床开发的用于治疗埃博拉病毒的GS-5734 对多种病毒,特别是SARS-CoV 和 MERS-CoV都有明显的抑制疗效,GS-5734的预防性和早期治疗显著降低了肺病毒载量,改善了临床症状以及呼吸功能。
Ralph S. Baric是该论文的第二通讯作者,论文的第一至第五作者,全都是Baric团队成员,其中第四作者Vineet D. Menachery(维内特·德梅纳赫里),就是2015、2016年两篇嵌合病毒论文的第一作者。
Ralph S. Baric及其团队还与美国陆军传染病医学研究院有着非常密切的合作。病毒改造的基础平台--反向遗传克隆平台,就是Ralph S. Baric团队与美国陆军传染病医学研究院,以及范德堡大学联合研发成功的,该平台功能极为强大,仅基于基因序列即可合成具有活性的病毒毒株,完全摆脱了对各种自然界来源的病毒毒株,包括蝙蝠冠状病毒毒株的病毒改造依赖,并且极大地简化了基因编辑、改造过程。Baric团队2015年病毒嵌合改造实验所用的培养病毒的Vero E6细胞,也美国陆军传染病医学研究院提供的。
注:Vero E6细胞,是一类非洲绿猴肾细胞系细胞,它在形成单层膜后显示出一定程度的接触抑制,最初用于繁殖一些复制缓慢的病毒,现在,该细胞系已被广泛用于麻疹病毒、埃博拉病毒、克里米亚-刚果出血热病毒、SARS病毒、新冠病毒等病毒的分离和生长。
(未完待续)




















